共軛焦顯微鏡
1.何謂雷射掃描共軛焦顯微鏡
在一般顯微鏡下所觀察的影像,都有來自聚焦面(focal plane)及非聚焦面(out-of focal plane)的光,故所提供的影像品質解析較差,也無法一層一層的深入樣品作顯微觀察。
共軛焦顯微技術利用通過光學針孔光圈(pinhole)蒐集來自樣品聚焦面的光所行成的影像,將非同一聚焦面的光排除於光學針孔光圈外所形成的共軛焦點影像(confocal image),去除傳統顯微鏡影像的迷光(stray light)能提供更高的光學解析,提供更佳的axial及lateral解析(point spread function)(見圖1)
透過此種技術,使用人員可任意依照樣品的厚度,指定樣品的上下點位置,設定每一光學切片的厚度,做連續的光學斷層掃描(如圖2);最後,可重組為一個立體影像(如圖3)、連續式的3D電影放映(如影片1),也可作各種角度的旋轉或切面觀察(如影片2)。
2.雷射掃描共軛焦顯微鏡系統的組成
雷射掃描共軛焦顯微鏡系統,主要是由包含A.雷射光源B.顯微鏡C.共軛焦掃描器D.電腦操控工作站E.應用軟體 所組成的。
| A. | 雷射光源 | |
| 雷射光源可提供極純的單一波長 (monochromatic),能量均一性 (high photon, energy),且雷射光束俱有固定的相位 (coherence),這些特性使得雷射光束可聚焦於一小點,所以可以有效的當作顯微掃描光源。 | ||
| 雷射光源包括 | ||
| a. | 可見光雷射光源 (visible laser): | |
| 包括離子雷射、氦氖雷射以及二極體雷射 | ||
| b. | 紫外光雷射光源 (UV Laser): | |
| 包括氦鎘雷射和氫離子紫外光雷射 | ||
| c. | 紅外光雷射光源 (IR Laser ): | |
| Ti-sapphire Ultrafast laser | ||
| d. | 白光雷射光源 (Whight Light Laser): | |
| 可發出440-790nm連續波段雷射。 | ||
| (本實驗室配備的雷射光源可參看「實驗室設備」) | ||
| B. | 顯微鏡 | |
| a. | 目前的共軛焦系統絕大部份都可使用於正立或倒立顯微鏡,掃描器可切換組裝於兩款顯微鏡 | |
| b. | 對UV和IR提供較高且較寬的波幅修正。 | |
| c. | 光學鏡頭使用高光學解析的高NA油鏡,例如 | |
| PL-APO 40x/1.25 Oil,PL-APO 63x/1.32 Oil, | ||
| PL-APO 63x/1.40 Oil,PL-APO 100x/1.32, | ||
| PL-APO 100x/1.40 | ||
| C. | 共軛焦掃描器 | |
| a. | 採用高解析的point-scanning 的掃描感測系統,基本上,有傳統式的濾鏡系統( filter-based )及新一代的分光光譜系統 (spectral-based),本實驗室的配備屬於後者。 | |
| b. | 在濾鏡系統設計上,主要是利用X-Y掃描鏡來作樣品X-Y座標取像,以Z-stage的升降作為Z-軸的縱身掃描取向,故X-Y-Z在配合時序的控制 (T) 即可作多樣性的組合掃描應用,例如X-T,Y-T,XY,XY-T,XYZ,XYZ-T ……等。 | |
| c. | 掃描器的反射螢光偵測可使用CCD Camera或PMT (photomultiplier) 來作為光子的感測;至於一般穿透光影像擷取如相位差 (phase contrast), 則是由安裝於顯微鏡內的穿透光感測器所偵測的。 | |
| d. | 本實驗室配備的掃描器為旋轉式K型掃描器 (K-scanner),能提供任何掃描速度的超高光學解析及多度空間的掃描 (nD : multi-dimentional scanning),其解析度達8192 x 8192 x 8192像素。 | |
| D. | 電腦操控工作站 | |
| a. | 電腦系統必須能穩定的操控所有軟硬體。 | |
| b. | 使用人員應建立自己的影像處理工作站,以共軛焦系統為影像擷取中心,再將結果單向傳輸至個人的電腦作進一步的編輯處理。 | |
| E. | 應用軟體 | |
| a. | 高階高速的影像處理軟體,人性化的簡易操作是發展的趨勢。目前,都往Windows10 的作業環境發展。 | |
| b. | 應用軟體除了影像擷取及3D立體重建外,長時間影像擷取記錄,細胞生理離子流應用,多重螢光分析,自動編輯程式等,都已是頗為成熟的發展。 | |
3.超解析共軛焦顯微鏡
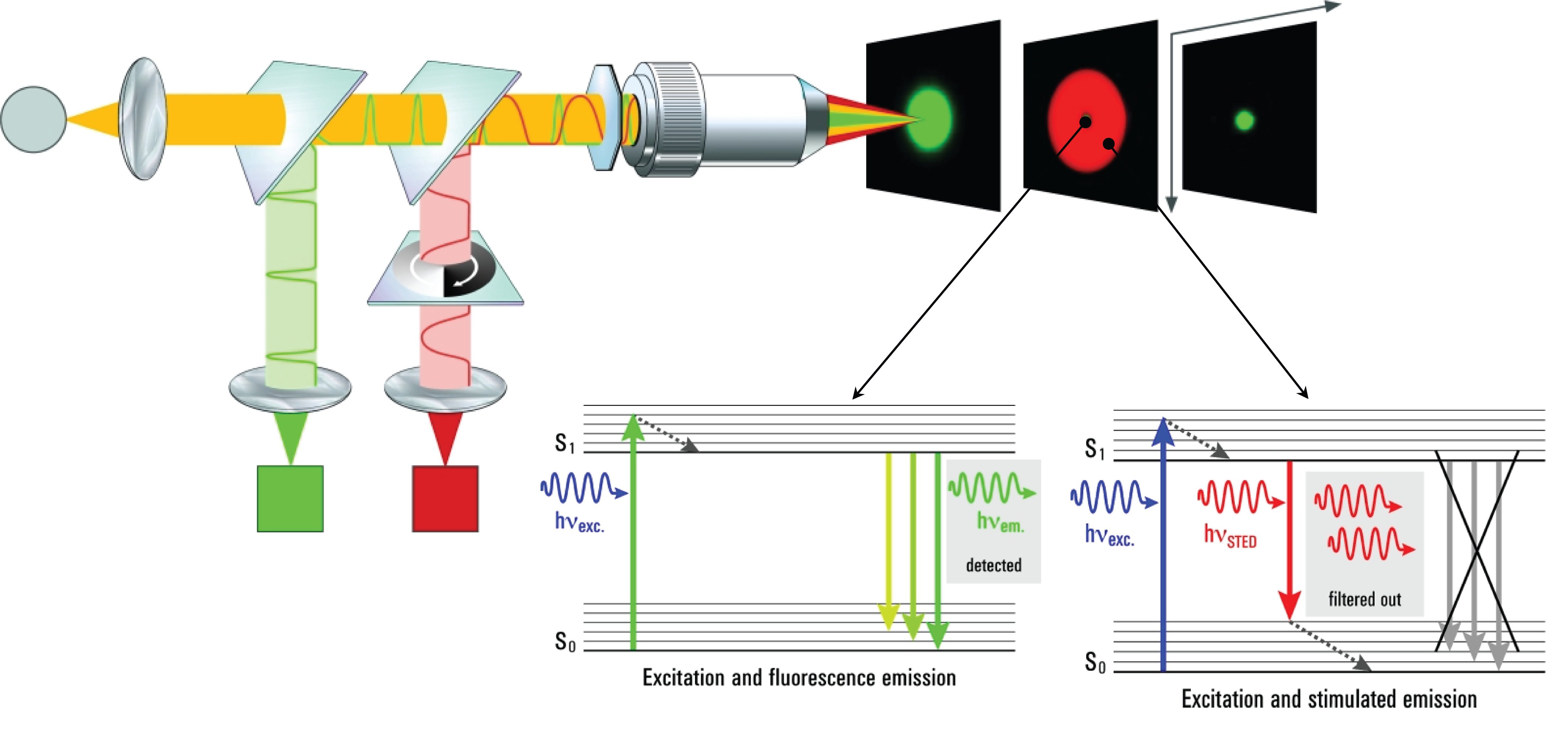
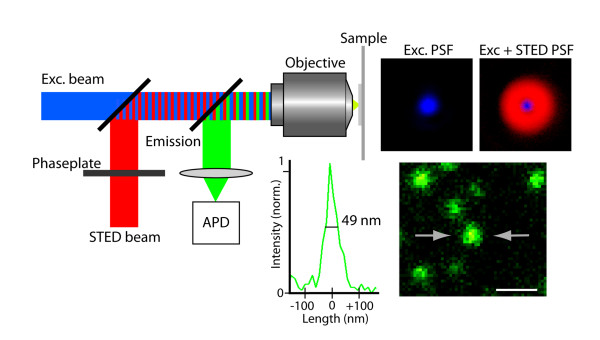
傳統的螢光顯微鏡,受限於阿貝理論的繞射障礙 (diffraction limitation),解析度始終無法突破<200nm。隨著科學的發展,近幾年來已有多位學者提出各式方法與理論,試圖突破阿貝繞射極限。本實驗室採用於2014年獲得諾貝爾獎的Stefan Walter Hell的STimulated Emission Depletion(STED)理論,在條件良好的情況下,理論上可成功將解析度提升至<50nm。
STED技術的核心概念是:假設一道光的聚焦永遠無法突破繞射極限,那就用兩道不同的光令其與螢光標誌交互作用而達成超高解析度的目標。這兩道光中,其中一道以平常手法聚焦的激發光用以激發螢光分子(excitation light)、另一道聚焦為甜甜圈圖案的抑制光 (depietion light) 則用以抑制除了甜甜圈中心之外所有被激發的螢光分子發光。
當甜甜圈圖案中心的孔洞小於繞射極限時,也就是說只有小於繞射極限範圍的螢光分子能夠正常發光時,其呈現的影像將超越繞射極限的影像解析度。
 |
 |
|
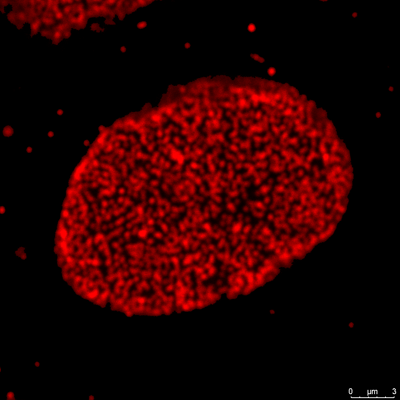
此圖為細胞使用共軛焦顯微鏡,在100倍物鏡下,經過4倍放大後所呈現的情形。影像解析度明顯下降。 |
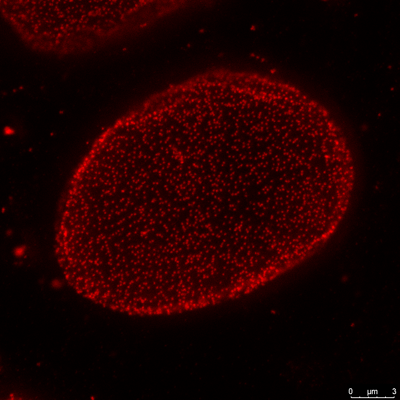
此圖為細胞使用超解析 (STED) 技術,在使用100倍物鏡下,經過4倍放大後所呈現的情形,大幅改善了原本模糊的影像。 |
| Cell type: Cos-7, Anti-Nup with Star 635P | |
| STED原理的相關影片: | |
| 1 | STED Confocal Super-Resolution - Leica TCS SP8 STED 3 |
| 2 | Microscopy: Super-Resolution: Overview and Stimulated Emission Depletion (STED) (Stefan Hell) |
| STED能將解析度提升,各項環境的配合非常重要,如要使用,請務必遵循下列各事項,以達到最好的效果: | |
| 1 | 盡量使用STED專用染劑,並使用STED depletion laser雷射775nm波長 |
| 市面上有販售STED專用染劑,請參考:abberior, SPIROCHROME | |
| 如真的無法配合,也可按照一般螢光染色:原廠建議的染色protocol及抗體 | |
| 2 | 螢光訊號盡量染強一點:由於STED需要多一支depletion laser掃描樣本,因此比較容易bleach |
| 3 | 蓋玻片請使用#1.5H,本核心實驗室有試用品,歡迎索取 |
| 4 | 封片膠請使用Mowiol, Glycerol, ProLongGold/Dimond,86% glycerol + 4% NPG (N-propyl-gallate),86% glycerol + 2.5%DABCO。 避免下列封片膠: Vectashield (Vectorlabs), Slowfade (invitrogen), Para-phenylenediamine (PPD) |
| Reference : | |
| 1 | 徠卡雷射掃描共軛焦顯微鏡之技術與應用概論,美嘉儀器股份有限公司共軛焦小組編譯,2000年8月。 |
| 2 | Stefan Hell, Wikipedia, January 14, 2021. |
| 3 | 儀器設備與收費標準-超解析螢光顯微鏡 Leica TCS SP8 X STED 3X, 台大顯微影像核心分子影像重點技術平台, 2021年1月。 |
| 4 | 3D STED (Stimulated Emission Depletion) Microscopy, Leica microsystems, January 25, 2021. |
| 5 | Hans Blom, Daniel Ronnlund, Lena Scott, Zuzana Spicarova, Jerker Widengren, Alexander Bondar, Anita Aperia, Hjalmar Brismar. Spatial distribution of Na+-K+-ATPase in dendritic spines dissected by nanoscale superresolution STED microscopy. BMC Neuroscience 2011, 12:16 |